Archive
7. Дулаан дамжуулалт
I. Дулаан дамжих нь
Дулааны энерги нь гурван янзаар дамжуулагддаг. Тэдгээр нь ямар орчноор дамжиж байгаагаасаа шалтгаалж ялгардаг.
Хэрэв дулаан нь хатуу биетээр, молекулуудын чичрэлтээр дамжиж байвал түүнийг биетийн дамжуулалт (conduction) гэж нэрлэнэ.
Хэрэв аливаа орчны (medium) шаардлагагүйгээр дулаан дамжиж байвал түүнийг цацрагаар (radiation) дамжилт гэж нэрлэдэг.
Хэрэв дулаан нь хөдөлгөөнтэй шингэнээр дамжиж байвал түүнийг конвекци (convection) гэж нэрлэнэ. Натурал конвекци нь нягтралын өөрчлөлтөд тулгуурлан өөрөө хөдлөх шингэнээр дамжих дулааныг хэлнэ. Шахсан конвекци нь (forced convection) насас, сэнс зэргийг ашиглан шингэнг хөдөлгөсөн нөхцөлд дамжих дулааныг хэлнэ.
Ууршилт, конденсаци зэрэг фазын өөрчлөлт нь конвекци гэж тооцогддог.
Энергийн дамжуулалт нь ихэнх тохиололд эхэндээ өөрчлөлттэй байх бөгөөд энэ үеийг шилжилтийн үе гэж нэрлэнэ. Энерги дамжуулалт нь улмаар тогтмол буюу тэнцвэртэй болно.
II. Биетийн дамжуулалт
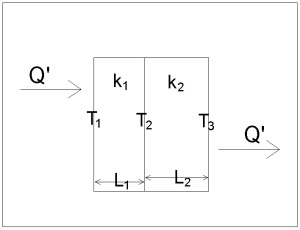
Хавтгай биетийг дамжих дулааныг Фурьегийн хуулиар (Fourier’s Law) илэрхийлнэ.
Q’ = -kA dT/dx
= -kA(T2 – T1)/L
Q’ = дулаан дамжуулалт, W буюу Ватт
А = дулаан дамжих талбай, м2
k = материалын дулаан дамжуулах чанар, (W/(m))K
dT/dx = температурын өөрчлөлт зайнаас хамааран өөрчлөгдөх хэмжээ, K/m2
L = дамжуулах материалын зузаан, m
L/(kA ) нь дулаан эсэргүүцэх чанар (R) гэж тодорхойлогддог.
Давхарласан материалуудыг дулаан дамжих нөхцөлд нийт дулаан эсэргүүцэх чанар нь материал тус бүрийн дулаан эсэргүүцэх чанаруудын нийлбэртэй тэнцнэ (R1 + R2 + R3 ….)
Эсэргүүцэх чанар буюу R нь:
R1 = L1/k1A
R2 = L2/k2A
гэх зэргээр тодорхойлогдно.
Дулаан дамжуулалтын хэмжээ буюу Q’ нь мэдэгдэж байгаа нөхцөлд аливаа материал буюу давхарласан материалууд дээрхи температурыг олж болдог.
Дээрхи зурагт харуулсан давхарласан материалын хувьд Температурыг олохын тулд эдгээр тэгшитгэлүүд хэрэглэгднэ.
Т2 = T1 – Q’R1
T3 = T2 – Q’R2
Дээрхи тэгшитгэлүүд нь (Фурьегийн хууль) дулаан дамжих талбай нь тогтмол хэмжээтэй болон дулаан дамжин явах материалын урт нь (L) тогтмол байна гэсэн ойлголт дээр тулгуурладаг.
Харин дулаан дамжих талбай нь тогтмол биш нөхцөлд `дундаж талбай`-г олж бодох шаардлагатай.
Дундаж талбай нь логарифмын талбай гэж бас нэрлэгдэх бөгөөд
Адундаж = (А2 – А1) / (ln(А2/А1))
гэсэн тэгшитгэлээр бодогдох болно.
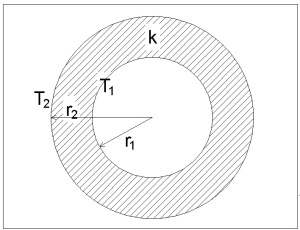
Дээрхи зураг дээр харуулсан мэт цилиндр хэлбэртэй хоолой, турбагаар дамжих дулааны дамжуулалт нь
Q’ = Адундаж k(T1 – T2)/LR
= 2πkLУ(Т1 – Т2)/(ln(r2/r1))
гэсэн тэгшитгэлээр тодорхойлогдох болно. LR нь радиус чиглэл дэх урт буюу хоолойны зузаан, LУ нь уртраг чиглэл дэх урт буюу хоолоны нийт уртыг тодорхойлж байгаа болно.
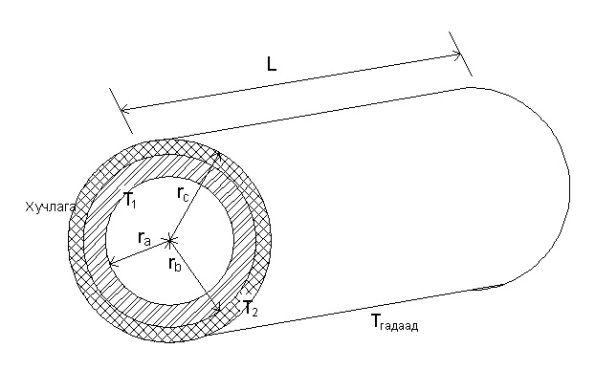
Дулаалга, тусгаарлагч зэргээр хучигдсан турба буюу төмөр утас зэрэг дээр хэтрүүлж хучлага хийвэл дулааны алдагдлыг ихэсгэдэг.
Хучлагын зузаан нь хэтэрч эхлэх тэр зузааны хэмжээг `заагийн зузаан` гэж нэрлэнэ. Тэрхүү зузааны радиусыг заагийн радиус гэж нэрлэнэ. Энэ нь
rзааг = kхучлага/hгадаад орчин
гэж тодорхойлогдно. h нь илчний дамжуулалтын коэффициент болно.
III Конвекци
Конвекци нь хөдөлгөөнтэй шингэний халалтаар дамжих дулааны дамжуулалт юм. Шахсан конвекци нь тоног төхөөрөмж ашиглан хөдөлгөөнт шингэнээр дулаан дамжуулахыг хэлнэ (насос, сэнс гэх мэт).
Шахсан конвекцийг `Ньютоны Конвекцийн Хууль` тодорхойлно. Тэр нь
Q’ = hA (Tw – Tгадаад орчин)
IV Цацрагийн дамжилт буюу радиаци
Цацрагаар буюу радиацаар дамжуулагдсан дулаан нь 700 nm –ээс 105 nm –ийн хоорондох долгионы урттай цахилгаан соронзон цацраг болно. Цацраг нь тэр чигтээ нэгэн долгионы урттай байвал `нэг өнгийн` цацраг гэж нэрлэгднэ.
Биетрүү цацарсан цацраг нь биед шингэж, эсвэл биетээс ойж, эсвэл биетээр дамжин явж болно.
Биетэд шингэсэн энергийг (absorbtion) а,ойсон энергийг (reflection) p, дамжин явсан энергийг (transmitted) т гэж тэмдэглэвэл эдгээр энергиүдийн нийлбэр нь цацрагийн нийт энергитэй тэнцүү болно.
а + p + т = нийт энерги.
хэрэв эдгээрийг бутархай тоогоор тэмдэглэж нийт энергийг 1 гэж тэмдэлгэвэл
а + p + т = 1.
Тунгалаг биш хатуу биетийг цацраг дамжин явахгүй (нэвтлэхгүй) учраас т = 0 гэж тооцно. Зарим шингэний хувьд бас цацраг дамжин явах боломжгүй учраас т = 0 байна. Хийнүүд нь цацрагийг ойлгохгүй учраас p = 0 гэж тооцдог.
`Идеал радиатор` буюу `хар биет` нь өөр дээр нь ирсэн цацрагийн энергийг тэр чигт нь шингээж авах бөгөөд а = 1 байна. Бодит ертөнц дээр хар биет нь онолын хувьд боломжтой боловч практикын хувьд биелдэггүй болно.
Тусгах чадвар (emissivity) нь аливаа биетийн дулаан дамжуулалтыг хар биетийн дулаан дамжуулалттай харьцуулсан харьцаа болно.
ε = Q’биет / Q’идеал радиатор
Хар биет буюу идеал радиаторын хувьд мэдээж ε = 1 байна.
Биетээс цацрагаар дамжин гарах энерги нь Стефан-Больцманы хуулиар илэрхийлэгднэ:
Q’цацраг = ε σ А Т4
σ = 5.67 х 10-8
А = биетийн гадаргын талбай,
Т = биетийн температур.
Хоёр биет хооронд дамжих дулааны энерги нь
Q’1-2 = σ А F1-2 (T14 – T24)
гэж тодорхойлогдох бөгөөд F1-2 нь хэлбэр байрлалын фактор бөгөөд биетүүдийн хэлбэр, тусгах чадвар, хоорондын чиглэл зэргээс шалтгаалан өгөгднө.
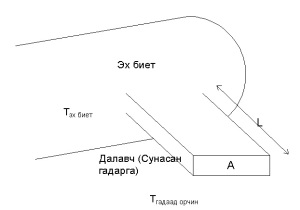
V Сунасан гадарга
Аливаа биетийн үргэлжилсэн гадарга буюу сунасан гадарга нь (extended surface) тухайн биетийн дулааны энергийг гадагшлуулан дамжуулж (кондукци) улмаар конвекци ба радиациар (цацраг) тэрхүү дулааны энергийг гадагш гарган шилжүүлдэг шинж чанартай байдаг.
Сунасан гадарга нь (далавч гэх мэт) гол зориулалтын хувьд өөр үүрэгтэй байдаг ч гэсэн дулаан дамжуулах буюу гадагшлуулах шинж чанартай юм.
Биетийн үргэлжилсэн (сунасан) гадарга нь тухайн эх биетээсээ дулаан дамжуулах дамжуулалтыг хэмжихийн тулд тухайн сунасан гадарга дээрхи цэг бүр дээр байгаа температурыг тогтмол гэж үзнэ.
Тэгш өнцөгт хэлбэрийн талбайтай сунасан гадаргын дулаан дамжуулалт нь
Q’ = √(h P k A) ×(Tэх биет – Tгадаад орчин ) × tan h({√(hP/kA)}L)
гэж тодорхойлогдно.
P нь талбайн периметрийг илэрхийлж байгаа болно.
6. Шаталт
Органик бодисуудын нэгдэл ба хүчилтөрөгч нь шаталтын урвалд ороход стехиометрийн хуулиуд үйлчлэнэ. “Стехиометрийн агаар” нь түлшийг бүрэн шатахад шаардлагатай хүчилтөрөгчийг хагнах хэмжээний агаарыг хэлнэ.
Стехиометрийн агаарыг хатуу болон шингэн түлш хэрэглэгдсэн нөхцөлд массаар харин хийн түлш хэрэглэгдсэн нөхцөлд эзлэхүүнээр тодорхойлдог.
Агаар/Түлшний харьцаа нь A/F гэж томъёологдох бөгөөд агаарын масс ба түлшний массын харьцаагаар
A/F = mair/mfuel
гэж тодорхойлогдно.
Агаар мандлын агаар нь хүчилтөрөгч, азот, CO2, усны уур болон бусад инертийн хийнүүдээс бүрднэ.
Стехиометрийн агаарт азот бий. Нэг моль хүчилтөрөгч тутамд 3.76 моль азот ба бусад хийнүүд шаталтын урвалын явцад өөрчлөгдөлгүй үлддэг.
Жишээ нь метан агаарт шатах процессийг
CH4 + 2O2 + 2(3.76)N2 à CO2 + 2H2O +7.52N2
гэж бичнэ.
“Бүрэн шаталт” нь түлш тэр чигтээ шатсан нөхцлийг илэрхийлнэ. Хангалттай хүчилтөрөгч байхгүй нөхцөлд дутуу шаталт болох бөгөөд CO буюу нүүрстөрөгчийн исэл бүрэлднэ.
“Онолын агаарын хувь” нь агаар/түлшийн бодит харьцааг стехиометрийн агаар/түлшийн харьцаатай харьцуулсан хувийг хэлнэ.
= (А/F)бодит / (А/F)стехиметрийн
Агаар /түлшний стехиометрийн харьцаа нь томъёоноос тооцоологдсон харьцаа бөгөөд бодит шаталтанд энэ харьцаанаас тооцоологдсоноос илүү их агаар шаардагддаг.
Өөрөөр хэлвэл “илүүдэл агаар” шаардлагатай.
Илүүдэл агаар = [(А/F)бодит – (А/F)стехиметрийн ] / (А/F)стехиметрийн
5. Хий, шингэн, уур зэргийн хольц найрлага
I. Идеал хийний хольцууд
Идеал хийний хольц нь идеал хийнүүдээс бүрдэх бөгөөд тэдгээр хийнүүд нь тус бүрдээ өөрийн шинж чанараа хадгалж эзлэхүүн дотор бие даан байгаа мэт байдалтай байна.
Идеал хийний хольцонд байгаа бүрдүүлэгч нэг хийний массын хувь ноогдол нь (wi, mass fraction) тухайн хийний массыг нийт массанд (m) харьцуулсан харьцаа гэж тодорхойлвол
wi = mi/m
болж байна. Массын хувь ноогдлуудын нийлбэр нь 1 буюу 100% болно.
Үүнчлэн бүрдүүлэгч нэг хийний молийн хувь ноогдол (xi, mass fraction) нь
хi = Ni/N
гэж тодорхойлогдох ба нийлбэр молийн хувь ноогдол 100% болно.
Бүрдүүлэгч хийний молекулын жин (МЖ) нь мэдэгдэж байвал хий тус бүрийн массын хувь ноогдол ба молекулын жингийн үржвэрийг нийт үржвэрт хувааж олно.
wi = хi (МЖ)i / Σ[хi (МЖ)I ]
Нийт молекулын жин нь нийт массыг нийт молийн тоонд хуваасантай тэнцнэ.
(МЖ) = m/N
= Σ[хi (МЖ)I ]
Массын хувь ноогдолыг молийн хувь ноогдолтой харьцуулвал
хi = [wi/(МЖ)i ]/ Σ[wi/(МЖ)i]
Даралт
Хийний хольц доторхи хий тус бүрийн даралтын нийлбэр эзлэхүүн доторхи нийт даралтыг бүрдүүлнэ. Үүнийг Далтоны хууль гэж тодорхойлдог.
p = Σ pi
Хольц доторхи нэгэн хийний даралтыг pi гэж тэмдэглэвэл
pi = mi RiT/V = xip
болно. T ба V нь хольцын температур ба эзлэхүүн бөгөөд Ri нь тухайн хийний тодорхой тогтмол (specific gas constant) нь болно. Энэ тогтмол нь хий тус бүр дээр хэмжигдсэн байх бөгөөд таблицууд дээр өгөгдсөн байдаг. Энэ тогтмол нь өгөгдөөгүй тохиолдолд универсаль хийний тогтмолыг тухайн хийний молийн жинд хуваан олно.
Эзлэхүүн
Хийний хольц дахь нэгэн хий тус бүрийн эзлэхүүн нь
Vi = mi RiT/p
гэж тодорхойлогдно. Хий тус бүрийн эзлэхүүний нийлбэр нь хольцын эзлэхүүнтэй тэнцүү.
V = Σ Vi
Идеал хийний хувд молийн хувь ноогдол нь даралт тус бүрийг нийт даралттай харьцуулсан харьцаатай, мөн эзлэхүүн тус бүрийг нийт эзлэхүүнтэй харьцуулсан харьцаатай тэнцнэ.
xi = pi / p = Vi / V
Энерги, энталпи, энтропи
Гиббсийн теорем (Gibbs Theorem): Идеал хийний хольцны нийт шинж чанар нь хий тус бүрийн шинж чанаруудын нийлбэртэй тэнцнэ, гэхдээ хий тус бүрийн шинж чанарууд нь нийт хольцын эзлэхүүн ба температуртай ижилхэн байгаа нөхцөл дээр бодогдсон байх шаардлагатай.
Идеал хийний хольцны хий тус бүр нь нэг бүрчлэн хольцны эзэлхүүнтэй бөгөөд температуртай адилхан байгаа нөхцлийн
нөхцөлд байхдаа
Хольцын дотоод энерги, энтальпи, дулааны багтаамж, хийний тогтмол зэрэг нь хольцыг бүрдүүлэгч хий тус бүрийн эдгээр чанаруудын нийлбэртэй тэнцүү болно.
Дотоод энерги = u = Σ wi ui
Энтальпи = h = Σ wi hi
Хийний холилдох үйл явц нь эргүүлж болохоор (циклээр) бөгөөд тогтмол энергитэй явагдвал (адиабат) хий тус бүрийн энтропийн нийлбэр нь нийт хольцын энтропитэй тэнцнэ. Гэхдээ энтропи тус бүр нь даралт тус бүр дээр (pi) өөрчлөгдөх учраас тухайн даралт дээр харгалзан үзэх ёстой.
Энтропи = s = Σ wi si
II. Шингэн ба уурны хольцууд
Шингэний дээр байрлаж байгаа уусамтгай хийний даралт нь шингэнд уусчихсан хийний даралттай пропорционал байна. Энэ ойлголтыг Хенригийн Хууль (Henry’s Law) гэх бөгөөд
pi = xih = yip
гэж тэмдэглэгднэ.
Уурны даралт:
Шингэн ба уур нь тэнцвэртэй байдалд (equilibrium) байх нөхцөлд уурын молекулуудын бий болгох даралтыг уурны даралт гэж нэрлэнэ.
Шингэн-хийний хольцын нэг бүрдүүлэгч бодисын өөрийнх нь дангаараа байх нөхцлийн уурны даралтыг pi* гэж тэмдэглэнэ.
Шингэн-уурын хольцын уурны даралт нь бүрдүүлэгч бодисын молийн хувь ноогдлыг дангаараа байх уурны даралтын үржвэртэй тэнцнэ.
pi = xi pi*
Энэ ойлголтыг Раулын Хууль гэж нэрлэдэг (Raoul’s Law) . Хольцын нийт уурын даралт бүрдүүлэгч бодисуудын уурын даралтуудын нийлбэртэй тэнцнэ.
PНийт = xA pA* + xB pB* + xC pC* + ….
Хольцын температур ихсэхтэй зэрэгцэн уурны даралт өснө.
III. Агаар мандлын судалгаа
Агаар мандал ба даралт:
Агаар мандлын (атмосферийн) агаарыг судлахын тулд түүнийг хуурай агаар ба усны уурын хольц гэж авч үздэг. Тиймээс атмосферийн агаарын даралт нь
p = pa + pv
буюу хуурай агаарын даралт ба усны уурын даралтын нийлбэр гэж тодорхойгдно.
Агаар мандал ба температур:
Атмосферийн агаарын температур нь гурван янзаар тодорхойлогдно:
- Хуурай температур, Тхуурай: Энгийн термометрээр агаарын температурыг хэмжвэл гарах температурыг илэрхийлнэ.
- Чийгтэй температур, Тчийг: Чийглэсэн термометрээр хэмжигдвэл гарах температурыг хэлнэ. Энэ нь чийгэнд нэвчсэн буюу адиабат процессоор чийглэгдсэн агаарын температурыг илэрхийлнэ.
- Шүүдрийн цэгийн температур, Тшүүдэр: Энэ нь чийглэг агаар хөрч конденсацид ороод тогтмол даралтын процессийн улмаас шүүдэр үүсч эхлэх үеийн тэр температурыг илэрхийлнэ.
Усны уурны ханалтын даралт (saturation pressure) нь аливаа температур дээрхи усны уурын тэнцвэртэй байдлын (equilibrium) даралтыг илэрхийлнэ. Агаарын даралт нь ханалтын даралт дээр байвал агаар нь ханасан нөхцөлд байна гэж тооцдог. Агаар ханасан нөхцөлд байвал
Тхуурай = Тчийг = Тшүүдэр
байна. Харин агаар нь ханалтанд ороогүй байвал
Тшүүдэр < Тчийг < Тхуурай
байдаг.
Атмосферийн агаарт байгаа усны хэмжээг агаарын чийглэг гэж тодорхойлох бөгөөд усны уурын массыг агаарын масстай харьцуулснаар илэрхийлдэг:
ω = mуур/mагаар
Агаар мандал ба Психрометр
Агаар мандал дахь агаарын шинж чанарыг судлах арга зүйг психрометр гэдэг. Агаарын шинж чанаруудыг термодинамик томъёогоор илэрхийлсэний оронд диаграм, графикаар илэрхийлж тайлбарлах нь илүү оновчтой бөгөөд психрометрийн диаграм нь энэ үүргийг гүйцэтгэдэг.
Жишээ нь психрометрийн диаграммаас агаарын энтальпийг олохын тулд мэдэгдэж байгаа чийглэгийн харьцаа ба агаарын хуурай температурыг зургаас харж олно.
Психрометрийн диаграмын жишээ:
 wikipedia
wikipedia
Фазын (Phase) харьцаанууд
Нэг фазаас нөгөөрүү шилжих нөхцлийг (уурнаас шингэнрүү гэх мэт) Клапейрон-Клаузиусын тэгшитгэлээр илэрхийлдэг. Энэ тэгшитгэлийн уур ба шингэний шилжилтийн нөхцлийн хувилбар нь
(dp/dT)ханалт = hууршилт/Tvууршилт = sууршилт/vууршилт
бөгөөд даралтын температуртай харьцуулсан өөрчлөлтийг энтальпи, эзлэхүүн, энтропи зэрэгтэй харьцуулсан байна.

wikipedia
Гиббсийн фазын дүрэм (Phase Rule)
Тэнцвэрт байдалд байгаа (equilibrium) хольцны фазууд ба бүрэлдэхүүнүүдийг Гиббсийн дүрэм ингэж тодорхойлно:
P + F = C + 2
P нь фазуудын тоо нь (шингэн, хатуу биет, хий), F нь хэмжигдэхүүний тоо нь (температур, даралт), С нь хольцод байгаа бүрэлдэхүүнүүдийн тоо болно.
Чөлөөт энерги
Цэвэр, хольцгүй бодисын Гиббсийн функц (g) нь
g = h – Ts = u + pv – Ts
гэж тодорхойлогдно. Энэ нь химийн урвалыг тодорхойлоход хэрэглэгдэх функц юм. Тогтмол температур ба даралттай нөхцөлд термодинамик системээс гарах үр ашигтай ажлыг энэ функц н илэрхийлдэг.
Гельмгольц чөлөөт энергийн функц нь (а) Гиббсийн функцтай ижилхэн үүрэгтэй бөгөөд
a = u – Ts = h – pv – Ts
гэж тодорхойлогдно.
4. Энтропи, Термодинамикийн 2-дугаар хууль
I. Энтропи ба энтропийн өөрчлөлт
Орчиндоо бүтээмжтэй ажил хийх боломжгүй болсон энергийн хэмжээг энтропи гэж тодорхойлж болно. Систем доторхи нийт энтропи нь систем үүсэхээс эхлэн цугларсан энтропийн үйлдвэрлэлийн нийлбэртэй тэнцнэ.
s2 – s1 = ∫ds = δQreversible /T.
∫ds = δQreversible /T.
(Qreversible = эргүүлж болох дулааны энерги )
Эргүүлж болох буюу циклийн процессд системийн энтропи нь хэвэндээ үлдэж болох бол эргүүлж үл болох процессд системийн энтропи нь заавал нэмэгднэ. Ямар ч процессд энтропи багасахгүй. Энэ ойлголтыг Клаузиусын тэнцвэргүй (Clausius Inequality) байдал гэж нэрлэдэг.
Процесс нь тогтмол температуртай орчинд явагдаж байгаа нөхцөлд энтропийн өөрчөлт нь
Δs = s2 – s1 = Q/T
гэж тодорхойлогдно.
Энтропи нь тогтмол процессийн (изэнтропи) явцад
Δs = s2 – s1 = 0
байна.
Адиабат буюу тогтмол энергитэй процессийн явцад
Δs ≥0
байна.
Системийн шингэний эзлэхүүн нь тогтмол бөгөөд дулааны багтаамж (Specific heat) нь тогтмол нөхцөлд нэгж массын энтропийн өөрчлөлт нь
s2 – s1 = ∫ c dT/T = c ln(T2/T1)
болно.
Циклээс гарч болох дээд хэмжээний буюу максимум ажлыг системийн бэлэн байдал (availability) гэж нэрлэнэ. Бэлэн байдал нь
φ = u – u0 – T0(s – s0) + p0(v – v0)
болно.
Эргүүлж болох ажил нь
Wreversible = φ1 – φ2
гэж тодорхойлогдно. Нээлттэй системийн хувьд эргүүлж болох ажил нь
Ψ = h – h0 – T0(s – s0) + v2/2 + gz
гэж тодорхойлогдох бөгөөд
энэ нөхцөлд
Wreversible = Ψ1 – Ψ2
болно.
Онолын хувьд эргүүлж болох ажил болон бодит ажлын хоорондох ялгааг процессийн харишгүй чанар (irreversibility) гэж тодорхойлогдно.
I = Wreversible – Wбодит
Дээд хэмжээний максимум ажил нь эргүүлж болох ажил дээр гардаг.
II. Термодинамикийн хоёрдугаар хууль
Термодинамикийн хоёрдугаар хуулийг хэд хэдэн тайлбараар тодорхойлдог бөгөөд хэвшмэл ганц тодорхойлолт байдаггүй болно. Эдгээр нь Клаузиусын тодорхойлолт, Келвин-Планкын тодорхойлолт зэрэг болно.
Хаалттай бөгөөд эргүүлж болох (цикл) систем дээр Хоёрдугаар Хуулийг тэгшитгэлээр илэрхийлсэн нь
dS = δQ/T
Энэ тэгшитгэл нь энтропийн өөрчлөлт (dS) нь дулааны өөрчлөлт буюу дулааны энергийн нэмэгдэл (δQ) нь системийн тэнцвэртэй байдлын температурт (Т) хуваагдсантай тэнцнэ гэж тодорхойлж байна.
Тэнцвэртэй байдлын нэг нөхцлөөс (Equilibrium) өөр нэгэн тэнцвэртэй нөхцөлрүү шилжих аливаа процесс нь энтропийн нэмэгдлийг бий болгоно гэсэн санааг энэ тэгшитгэл агуулж байна.
Келвин-Планкын тодорхойлолт (дулааны хөдөлгүүрийн тодорхойлолт):
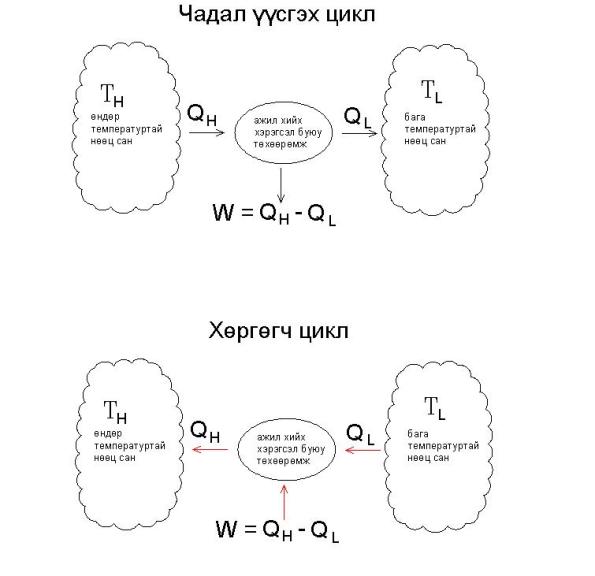
Чадал үүсгэх цикл буюу дулааны хөдөлгүүр нь (Heat Engine) дулааны нөөцөөс гарах энергийг бүгдийг нь хөдөлгөөний энерги болгон хувиргах боломжгүй.
Өөрөөр хэлвэл аливаа цикл буюу дулааны хөдөлгүүр нь өндөр температуртай нөөц сангаас авсан энергиэс заримыг нь гадаад орчинд буюу бага температуртай нөөц санруу заавал алдна гэсэн үг.
Иймээс Карно цикл нь байж болох хамгийн дээд хэмжээний хөдөлгүүр гэсэн үг юм. (“Чадал үүсгэх үндсэн циклүүд” сэдвийг харна уу)
Клаузиусын тодорхойлолт:
Дулааны энергийг бага температуртай орчноос өндөр температуртай орчинруу дамжуулах боломжгүй.
Иймээс дулааны энерги хүйтнээс халуунруу дамжихын тулд системд заавал гадны оролцоотой ажил шаардагдна. Жишээ нь хөргөгчийн систем нь компрессорын ажиллагаагаар хийгддэг.
3. Чадал үүсгэх үндсэн циклүүд
I. Үндсэн циклүүд
Термодинамик процессийн явцад дулааны энерги ялгаран ажил хийгдэж болох боловч хангалттай удаан хугацаатай ба ашигтай хэрэглэж болох ажил, энергийг гарган авахын тулд термодинамик цикл буюу эргэлтүүд байх чухал. Цикл буюу эргэлт нь системийн анхны байдал төлөвт нь эргүүлэн авчрах олон үргэлжилсэн процессуудыг нийтэд нь хэлнэ. Ихэнх термодинамик процессууд нь үргэлжлэн дахин давтагдах циклээр явагддаг.
Системийн энергийн эх үүсвэр нь (шаталт, цахилгаан халаалт, цөмийн урвалаас гарах дулаан гэх мэт) өндөр температуртай нөөц сан (TH) гэж илэрхийлэгдээд энэ эх үүсвэрээс системрүү орох дулааны энергийг өндөр температурын дулааны энерги (QH) гэж илэрхийлэхэд тохиромжтой байдаг.
Үүнчлэн системээс гарах дулааны энергийг бага температурын дулааны энерги (QL) гэж илэрхийлэхэд тохиромжтой бөгөөд энэ энерги нь бага температуртай нөөц санруу (TL) урсаж очиж байгаагаар илэрхийлэхэд тохиромжтой. Доорхи зурагт харуулсанчлан чадал үүсгэх цикл (power cycle) дээр энерги нь өндөр температуртай нөөц сангаас ажил хийгч төхөөрөмжрүү шилжин, тухайн төхөөрөмж нь ажлыг бий болгож гадаад орчинруу (бага температуртай нөөц сан) дулааны энерги алдна. Харин хөргөгч цикл (refrigeration) дээр ажил хийх төхөөрөмж нь бага температуртай нөөц сангаас дулааныг өндөр температуртай нөөц санруу дамжуулан шилжүүлж ажиллана.
Цикл буюу эргэлт нь тухайн системийг ажиллуулах шингэн (working fluid) болон өндөр температуртай нөөц сан, бага температуртай нөөц сан, системрүү энерги орж ирэх арга нөхцөл, системийн ажил хийх арга нөхцөл зэргээс бүрэн шалтгаалдаг.
Системийг ажиллуулах шингэн нь системд энергийг дамжуулах шингэнг хэлэх бөгөөд бодит практик дээр машиныг ажил хөдөлгөөнд оруулах шингэнг хэлнэ. (Жишээ нь уурын хөдөлгүүрийн уур, гидравлик шингэн, моторын шатах түлш.)
Чадал үүсгэх циклийг хийх төхөөрөмжийг дулааны хөдөлгүүр гэж нэрлэнэ (heat engine). Чадал үүсгэх циклийн дулааны үр ашгийн коэффициент нь циклийн гаргах нийт ажлыг циклд орсон нийт дулааны энергитэй харьцуулсан харьцаа болно. Авсан дулааны энергитэйгээ харьцуулвал хэр их хэмжээтэй ажил хийх вэ гэдгийг харуулна гэсэн үг:
η = (WL – WH) / QH
= (QH – QL) / QH
(WL – WH) нь нийт системийн бага температуртай нөөц сан дээр хийсэн ажил ба өндөр температуртай нөөц сангаас хийгдсэн ажлын ялгаа, өөрөөр хэлвэл `нийт ажил` буюу `цэвэр ажил` (net work, WN ) гэсэн үг.
(QH – QL) нь өндөр температуртай нөөц сангаас шилжих дулааны энерги ба бага температуртай нөөц санруу шилжих энерги, өөрөөр хэлвэл нийт буюу `цэвэр дулааны энерги` (net work, QN) болно.
Термодинамикийн нэгдүгээр хуулийн дагуу системд орох нийт буюу цэвэр дулааны энерги нь системийн нийт хийгдсэн ажилтай тэнцэх учраас WN = QN байх учиртай. Эндээс чадал үүсгэх циклийн дулааны үр ашгийн коэффициентийг дахин бичвэл
η = WN / QH
= QN / QH
болно.
Карно Цикл / Carnot Cycle
Карно цикл нь чадал үүсгэх `идеал` цикл бөгөөд бодит амьдрал практик дээр үүсгэх боломжгүй тийм цикл юм. Тиймээс Карно цикл нь аливаа дулааны хөдөлгүүрийн гаргаж болох хамгийн дээд талын ажлыг хэмжих зэрэгт хэрэглэгдэх учраас ач холбогдолтой байдаг. Карно циклийн `ажиллуулах шингэн` нь юу байх нь чухал биш бөгөөд циклийн ажиллагаанд хамааралгүй байдаг.
Карно циклийг гурван янзаар илэрхийлсэн нь (P-v, T-s, h-s):
(P-v) буюу даралт ба эзлэхүүн гэсэн тэнхлэгүүд дээр Карно цикл нь ингэж илэрхийлэгднэ.

(T-s) буюу температур ба энтропи гэсэн тэнхлэгүүд дээр Карно цикл нь ингэж илэрхийлэгднэ.
 (h-s) буюу энтальпи ба энтропи гэсэн тэнхлэгүүд дээр Карно цикл нь ингэж илэрхийлэгднэ.
(h-s) буюу энтальпи ба энтропи гэсэн тэнхлэгүүд дээр Карно цикл нь ингэж илэрхийлэгднэ. 
http://mit.edu/16.unified/www/FALL/thermodynamics/notes
Дээрхи зургуудад илэрхийлэгдсэнээр Карно циклийн процессууд нь:
a -> b: изотермал буюу температур нэг хэвийн нөхцөлд ханасан шингэнээс ханасан уур болон тэлэх явц (эзлэхүүн нэмэгднэ)
b -> c: изэнтропи буюу энтропи нь тогтмол нөхцөлд уур тэлэлт (эзлэхүүн нэмэгднэ)
c -> d: изотермал буюу температур нэг хэвийн нөхцөлд уур шахагдалт (эзлэхүүн багасна)
d -> a: изэнтропи буюу энтропи тогтмол нөхцөлд шахагдалт (эзлэхүүн багасна)
Карно цикл нь хамгийн өндөр үр ашигтай чадал үүсгэх цикл юм. Дулааны үр ашгийн коэффициент нь Карно цикл дээр:
η Carnot = (ТH – ТL )/ ТH
байна.
Ренкин Цикл / Rankine Cycle
Ренкин цикл нь уурын турбинээр ажиллах цахилгаан станцын цикл эргэлт бөгөөд Карно циклтэй төстэй. Ренкин цикл нь практик бодит амьдрал дээрхи цикл учраас онолын хувьд идеал Карно циклээс үр ашгийн хувьд бага. Ренкин цикл дээрх шахагдал нь (эзлэхүүний багасалт, compression) шингэн төлөв дээр явагддагаараа Карно циклээс ялгаатай юм.
Доорхи зураг нь Ренкин цикл буюу цахилгаан станцын уурын турбинг харуулж байна.

http://mit.edu/16.unified/www/FALL/thermodynamics/notes
Дээрхи зурагт харуулсанчлан гаднаас шаталтын дулаан авах (Q’in) буцалгагч (Boiler) дотор ууршуулах процесс явагдаж буцалгагчаас уур нь турбинруу орно. Турбин дотор изэнтропи тэлэлт явагдаж турбин нь ажил хийнэ (W’t). Турбинтэй холбогдсон конденсатор нь (Condenser) илүүдэл уурыг ус болгон хөргөж усыг шахуургаруу дамжуулна. Конденсатор нь гаднаас авсан хөргөх усыг (cooling water) ашиглаж ажиллах бөгөөд гадагшаа дулааныг алдна (Q’out) . Шахуурга (насос) нь гаднаас авсан ажлаар (W’p) конденсатороос орж ирэх шингэнг шахаж буцаан буцалгагчруу шахан оруулна. Зураг дээрхи тэмдэглэгээгээр
a -> b: буцалгагч доторхи ууршуулалт (даралт тогтмол, температур тогтмол, энтропи ихэснэ)
b -> c: турбин доторхи изэнтропи тэлэлт (энтрөпи тогтмол, температур буурна, даралт буурна, W’t нь цахилгаан үүсгүүрийг эргүүлэх ажил юм)
c -> d: конденсаци (температур буурсан хэвэндээ байна, энтропи багасна, даралт хэвэндээ байна)
d -> e: изэнтропи шахалт буюу насос дотор явагдах процесс (даралт ихэснэ, температур ихэснэ, энтропи тогтмол)
e -> a: шингэнг уур болтол халаах явц процесс (температур ихэснэ, даралт ихэснэ, энтропи ихэснэ)
Эдгээрийг графаар илэрхийлвэл:
(P-v) буюу даралт ба эзлэхүүн гэсэн тэнхлэгүүд дээр Ренкин цикл нь:

(T-s) буюу температур ба энтропи гэсэн тэнхлэгүүд дээр Ренкин цикл нь:

(h-s) буюу энтальпи ба энтропи гэсэн тэнхлэгүүд дээр Ренкин цикл нь:

http://mit.edu/16.unified/www/FALL/thermodynamics/notes
Нийт Ренкин циклийн дулааны үр ашгийн коэффициент (Thermal Efficiency) нь
η Thermal = (Wt – Wp )/ QH
буюу турбины хийх ажил ба насосыг ажиллуулахад орсон ажлын ялгааг (Wt – Wp ) буцалгагчруу оруулсан нийт дулааны энергид (QH) хуваасан харьцаагаар бодож болно. Энтальпиг ашиглан нийт циклийн үр ашгийг бодвол
η Thermal = [(hb – hc) – (he – hd)] / (hb – he)
байна.
Шаталтын цикл: Отто цикл буюу дотоод шаталтат хөдөлгүүр
Отто цикл нь очноос асалт авах дотоод шаталтат бүлүүрт хөдөлгүүрт явагдах процессуудыг хэлдэг. Дотоод шаталттай хөдөлгүүр нь 2 буюу 4 цохилттой (Stroke) байна. Дотоод шаталтат хөдөлгүүр нь шатахуун ба агаарын хольцыг гаднаас аваад тэр түлшээ шахалтанд оруулаад урвалд орох нөхцлийг бий болгоно. Ингэснээрээ химийн энергийг дулааны энергид хувиргаж чадна. Тэгээд шатаагдсан бүтээгдэхүүнийг гадагш нь гаргахын зэрэгцээ шинээр шатахуун-агаарын хольц түлш гаднаас оруулж ирнэ.
Идеал Отто циклийг графикаар дүрсэлвэл:

http://mit.edu/16.unified/www/FALL/thermodynamics/notes
- Оруулж ирэх цохилт: газолин, уур ба агаарын хольц хөдөлгүүрлүү орно. (5 -> 1)
- Шахалтын цохилт: даралт ба температур ихэснэ. Энтропи нь тогтмол буюу изэнтропи (1 -> 2)
- Шаталт: богино хугацаатай бөгөөд бараг тогтмол эзлэхүүнтэй байх бөгөөд даралт ихэснэ. (2 -> 3) Идеал Отто цикл дээр гаднаас ахин хэрэглэгдэх дулаан (QH) орж ирнэ.
- Чадлын цохилт (power stroke): тэлэлт явагдаж бүлүүр түлхэгднэ, даралт багасна. Энтропи нь тогтмол буюу изэнтропи (3 -> 4)
- Гадагшлах хавхлаг (exhaust valve): хавхлаг онгойж хийг гадагшлуулна
- Дулааны шилжүүлэлт: Идеал Отто цикл дээр дулаан ахин хэрэглэгдэх зорилготойгоор нөөц санруу шилжнэ (4 -> 1)
- Гадагшлуулалтын цохилт: шатаагдсан түлшний үлдвэр утааг бүлүүр гадагшлуулна.
Идеал биш практик бодит амьдрал дээрхи дотоод шаталтат хөдөлгүүр дээр процессууд нь шулуун бөгөөд хурц өөрчлөлтүүдгүйгээр явагдна. Доорхи зураг нь бодит дотоод шаталтат хөдөлгүүрийн циклийг харуулж байна.
 http://mit.edu/16.unified/www/FALL/thermodynamics/notes
http://mit.edu/16.unified/www/FALL/thermodynamics/notes
Доорхи зураг нь бүлүүрийн цохилтуудыг харуулж байна.

http://mit.edu/16.unified/www/FALL/thermodynamics/notes
Идеал Отто циклийн буюу дотоод шаталтат хөдөлгүүрийн үр ашгийн коэффициент нь
η Otto = хийгдсэн ажил / авсан дулааны энерги
гэж илтгэгдэх боловч үүнийг хэмжихэд илүү хялбарчилсан томъёогоор ихэвчлэн илэрхийлнэ:
η Otto =1 – (V1/V2)(1 – к)
k = дулааны багтаамжын харьцаа = cp / cv
(V1/V2) = шахалтын харьцаа = rv
Эндээс харвал шаталтат хөдөлгүүрийн үр ашгийн коэффициентийг олохын тулд шахалтын харьцаа ба дулааны багтаамжын харьцаа л байхад хангалттай байна.
Хөргөгчийн циклүүд
Хөргөгчийн циклүүд нь дулааны хөдөлгүүрүүдийн циклүүдээс эсрэг зарчмаар ажиллах бөгөөд хөргөгчийн циклд дулаан нь бага температуртай газраас өндөр температуртай газарлуу шилждэг. Сэдвийн эхэнд тавьсан зургыг дахин харуулвал:
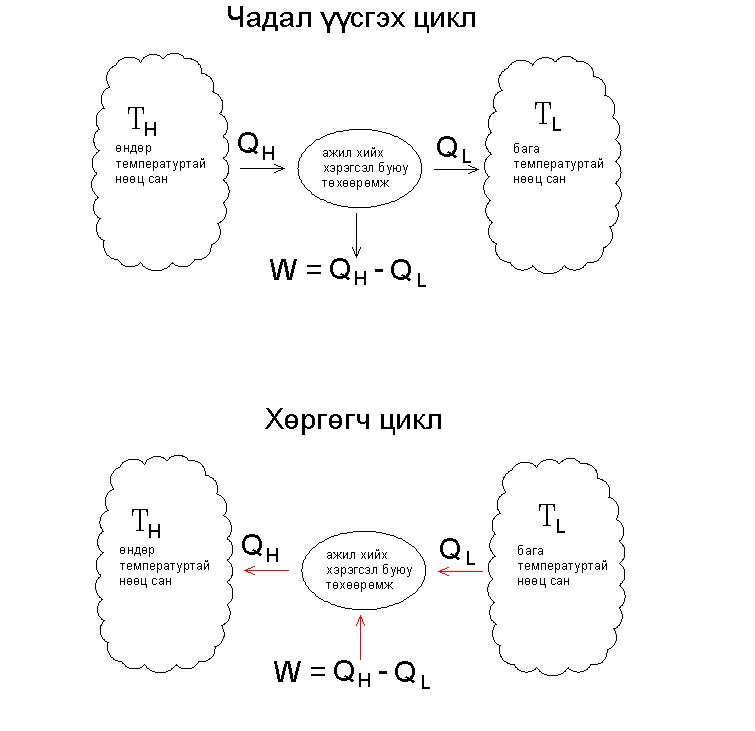
Дулаан нь өөрөө зөвхөн халуун орчноос хүйтэнрүү шилжин явдаг учраас хөргөгч цикл нь гаднаас энерги авч хүчээр дулааныг бага температурын орчноос өндөр температурын орчинруу шилжүүлэх шаардлагатай. Гаднаас авах энерги нь шахуурга, насос, эсвэл компрессороор дамжин хөрөх бодис дээр ажил хийнэ. Хөрөх бодис (refrigerant) дээр ажил хийгдсэнээрээ энерги нь өндөр температуртай орчинруу шилжих нөхцөл бүрддэг.
Чадал үүсгэх цикл буюу дулааны хөдөлгүүр дээр шаталтаас гарсан дулааны энерги нь системд орж ажил нь системээс гардаг бол харин хөргөгч цикл дээр ажил нь системд орж хөргөлт нь системийн бүтээгдэхүүн болдог.
Хөргөгчийн эд анги нь ууршуулагч, конденсатор, компрессор, ба даралт багасгагч хавхлаг зэрэг байдаг. Ууршуулагч (evaporator) аппарат нь дулааныг өөртөө татан авдаг бол хөргөгчийн конденсатор нь дулаан гадагшлуулах үүрэгтэй байна.
Хөргөгч ажиллах үеэр хөргөгч бодис нь (refrigerant) ууршуулагч буюу шингэн дамжуулах ороомог хоолойгоор дамжин өндөр температуртай газраас дулааныг шүүн авч ууршина. Ууршсан хөргөх бодис нь компрессороор шахагдаж температур нь улам ихсэнэ. Өндөр даралт ба температуртай болсон хөргөх бодис нь тэндээс конденсаторын ороомог хоолойгоор дамжиж дулааны энергиэ гадагш нь алдаж шилжүүлнэ. Тэндээсээ хөргөх бодис нь даралт багасгах хавхлаг буюу өргөсөх хавхлагаар дамжин даралт нь буурна.
Агааржуулагч (air conditioner), хөргөгч (refrigerator), ба ус хөргөгч (chiller) нь энэ зарчмаар ажиллана. Дулааны насос нь (heat pump) мөн хөргөгч циклийг ашиглан дулаан шилжүүлэх үүрэг гүйцэтгэдэг.
Хөргөгч цикл дээр үр ашгийн коэффициент биш харин Хүчин Чадлын Коэффициент (coefficient of performance) хэрэглэгднэ.
Хөргөгчийн хүчин чадлын коэффициент нь
COPrefrigerator = QL / W
буюу хөргөгчөөс гаргах дулаан ба түүнд орсон ажлын харьцаатай тэнцнэ.
2. Термодинамик процессууд, Термодинамикийн нэгдүгээр хууль
I. Термодинамик процессууд
Термодинамикт `систем` гэсэн ойлголт нь маш чухал бөгөөд үндсэн ойлголт болно. Термодинамикийн бодлогод Систем ба гадаад орчинг ялган салгаж системийг тойрох хилээр тусгаарлах бөгөөд систем доторхи үйл явцыг термодинамикийн процесс гэж тодорхойлно.
Термодинамикийн үндсэн түгээмэл процессуудыг нэрлэвэл:
Адиабат процесс – системээс энерги орж гарахгүй, тогтмол энергитэй процессийг хэлнэ.
Изэнтропи процесс – энтропи өөрчлөгдөхгүй процессийг хэлнэ. Энтропи нь тогтмол байх учраас изэнтропи процесс нь эргэж болно гэсэн үг.
Изэнтальпи proцесс – тогтмол энтальпитэй процессийг хэлнэ.
Изобар процесс – тогтмол даралттай процессийг хэлнэ.
Изотерм процесс – тогтмол Температуртай процессийг хэлнэ.
Изохор процесс – тогтмол эзлэхүүнтэй процессийг хэлнэ.
Политропи процесс – (p vn = тогтмол) гэсэн тэгшитгэлээр тодорхойлогдох процесс. n нь системийн `политропийн индекс` бөгөөд системээс шалтгаалан өөр өөр байна.
Шахагдмал процесс – (throttling process) даралтын өндөр уналттай адиабат процесс. Шахагдмал процессд энтальпи тогтмол байх учраас бас изэнтальпи процессд хамаарагдна.
Термодинамикийн тэнцвэрт байдал буюу equilibrium нь аливаа өөрчлөлтөнд хамрагдаагүй нөхцөл байдлыг хэлнэ. Процессийн эхлэлд ба төгсгөлд тэнцвэрт байдалд байгаа (equilibrium) систем нь процессийн үйл явц дунд тэнцвэрт байдалтай байхгүй байж болно. Квази-тэнцвэрт буюу Квазистатик процесс нь (тэнцвэрт нөхцөлтэй ойрхон) шат шатаар тэнцвэртэй байдалтай ойрхон нөхцлүүдийг дамжин үргэлжлэх удаан процесс болно.
Эргүүлж болох процесс (reversible) нь систем эхнийхээ байсан нөхцөлд ахин очиж болох процессийг хэлнэ. Квази-тэнцвэрт процесс нь эргүүлж болох процесс мөн юм.
II. Термодинамикийн Нэгдүгээр Хууль
Энерги нь бүтээгддэггүй бас устгагддаггүй харин төлөвөөсөө хувиран өөрчлөгддөг (кинетик энергиэс химийн энерги гэх мэт). Энэ ойлголтыг энерги хадгалагдах хууль гэж нэрлэнэ. Термодинамикийн нэгдүгээр хууль нь энерги хадгалагдах хуулийн нэгэн илэрхийлэл гэж хэлж болох юм.
Термодинамикийн нэгдүгээр хууль: системд орж ирэх энерги нь тэрхүү систем доторхи энергийн өөрчлөлттэй тэнцнэ.
Тиймээс системийн дотоод энергийн өөрчлөлт нь системд орж ирсэн дулаан ба системийн орчин тойрондоо хийсэн ажлын ялгаатай тэнцнэ.
Термодинамикийн Систем нь нарийн тодорхойлон сонгон авсан эзлэхүүнийг хэлэх бөгөөд хилээр хүрээлэгдсэн байна. Хилээс гаднах орчныг гадаад орчин гэж нэрлэнэ. Системээр аливаа масс дамжин явсан нөхцөлд тэр систем нь нээлттэй систем гэж тодорхойлогдно (Насос/шахуурга, турбин, тийрэлтэт хөдөлгүүр зэрэг нь нээлттэй системийн жишээ болно). Масс системийг дамжин яваагүй тохиолдолд тэр систем нь хаалттай систем гэж тодорхойлогдно. Хаалттай систем доторхи эзлэхүүн нь өөрчлөгдөж болно ( Моторын бүлүүр доторхи эзлэхүүн өөрчлөгдөх нь ийм системийн нэг жишээ болно.)
Нэмэх ба хасах тэмдгээр энерги, энтальпи, энтропи, ажил ба дулааныг хэрхэн илэрхийлэх вэ? Стандарт илэрхийллээр
- Дотоод энерги (ΔU), энтальпи (ΔH), энтропи (ΔS) нар нь систем дотор ихэссэн тохиолдолд эдгээрийг нэмэх тэмдгээр илэрхийлнэ. Эдгээр нь багасвал хасах тэмдгээр илэрхийлнэ.
- Ажил нь системээс гаднах орчин дээр хийгдсэн нөхцөлд нэмэх тэмдгээр илэрхийлэгднэ. Систем дээр гаднах орчноос ажил хийгдсэн бол хасах тэмдгээр илэрхийлэгднэ.
- Дулаан нь системрүү орж ирвэл нэмэх тэмдгээр, системээс дулаан гаднах орчинруу гарвал хасах тэмдгээр илэрхийлэгднэ.
III. Хаалттай системүүд
Термодинамикийн нэгдүгээр хуулиар хаалттай систем нь
Q – W = ΔU+ ΔKE + ΔPE
гэж тодорхойлогдно. Хаалттай системд орж ирсэн дулааны энерги нь (Q) системийн дотоод энергийг (U) өөрчилж (өөрөөр хэлвэл халааж) чадах буюу эсвэл системийн орчин тойрон дээр ажил хийлгэж (W), мөн системийн кинетик ба потенциал энергийг өөрчилж (ΔKE + ΔPE) чадна.
Эргүүлж болох ажил нь (reversible work) даралт-эзлэхүүний ажил гэж бас нэрлэгдэх бөгөөд
Wreversible = ∫p dV
буюу
dW = p dV
гэсэн дифференциал тэгшитгэлээр тодорхойлогдно. Даралт нь (p), эзлэхүүн нь (V) болно.
Хаалттай системд хэрэглэгдэх тэгшитгэлүүд
Тогтмол даралттай буюу изобар процесс:
T / V = тогтмол
W = p ΔV
гэсэн тэгшитгэлүүд тогтмол даралттай нөхцлийн хаалттай системд үйлчилнэ. (Т = температур; W = ажил, p = даралт; ΔV = эзлэхүүний өөрчлөлт)
Тогтмол эзлэхүүнтэй буюу изохор процесс:
T / p = тогтмол
W = 0
гэсэн тэгшитгэлүүд тогтмол эзлэхүүнтэй нөхцлийн хаалттай системд үйлчилнэ. Тогтмол эзлэхүүнтэй процессийн явцад ажил хийгдэхгүй (W = 0).
Тогтмол температуртай буюу изотерм процесс:
p V = тогтмол
W = R T ln(V2/V1) = R T ln(P1/P2)
гэсэн тэгшитгэлүүд тогтмол температурын нөхцлийн хаалттай системд үйлчилнэ. (R = универсал хийний тогтмол)
Тогтмол энтропи-тэй буюу изэнтропи процесс:
pVk = тогтмол
W = (p2V2 – p1 V1) / (1 – k)
= R (T2 – T1) / (1 – k)
= (RT1/(k – 1)) (1 – (p2/p1)(k – 1)/k)
k = cp / cv
гэсэн тэгшитгэлүүд изэнтропи процессийн нөхцөлд хаалттай системд үйлчилнэ.
Политропи процесс:
pvn = тогтмол
W = (p2V2 – p1V1) / (1 – n)
гэсэн тэгшитгэлүүд политропи процессийн нөхцөлд хаалттай системд үйлчилнэ.
IV. Нээлттэй системүүд
Нээлттэй системийг масс дамжин явна. Нээлттэй системийн жишээнүүд нь насос, дулааны солилцуур, тийрэлтэт хөдөлгүүр зэрэг юм. Термодинамикийн нэгдүгээр хуулиар нээлттэй системийг тодорхойлсон нь
Q = ΔU+ ΔKE + ΔPE + Wreversible + Wshaft
болно. Системд орж ирсэн дулаан нь дотоод энергийн өөрчлөлт (халалт), кинетик ба потенциал энергийн өөрчлөлт, мөн эргүүлж болох ажил (Wreversible ) ба арал тэнхлэгийн ажил (Wshaft) зэргийн нийлбэртэй тэнцнэ. Арал тэнхлэгийн ажил нь турбины эргэлтийн ажил гэх зэрэг эргэлтийн ажлыг хэлнэ.
Арал тэнхлэгийн ажил хийгдээгүй нөхцөлд нээлттэй системийн эргүүлж болох ажил нь
Wreversible = – ∫V dp+ ΔKE + ΔPE
байна.
Нээлттэй системд хэрэглэгдэх тэгшитгэлүүд
Тогтмол эзлэхүүнтэй буюу изохор процесс:
W = -V(p2 – p2)
гэж тогтмол эзлэхүүнтэй нөхцлийн нээлттэй системд ажил тодорхойлогдно.
Тогтмол даралттай буюу изобар процесс:
W = 0
Тогтмол даралттай нөхцлийн нээлттэй системд ажил хийгдэхгүй.
Тогтмол температуртай буюу изотерм процесс:
p V = тогтмол
W = R T ln(V2/V1) = R T ln(P1/P2)
гэж тогтмол температуртай нөхцлийн нээлттэй системд тодорхойлогдно.
Тогтмол энтропи-тэй буюу изэнтропи процесс:
pVk = тогтмол
W = k (p2V2 – p1 V1) / (1 – k)
= k R (T2 – T1) / (1 – k)
= (k RT1/(k – 1)) (1 – (p2/p1)(k – 1)/k)
k = cp / cv
гэсэн тэгшитгэлүүд изэнтропи процессийн нөхцөлд нээлттэй системд үйлчилнэ.
Политропи процесс:
pvn = тогтмол
W = n (p2V2 – p1V1) / (1 – n)
гэсэн тэгшитгэлүүд политропи процессийн нөхцөлд нээлттэй системд үйлчилнэ.
V. Тогтмол урсгалын системүүд
Системээр дамжин явах массын урсгалын хэмжээ нь тогтмол нөхцөлд тэр системийг `тогтмол урсгалын систем` гэнэ. Термодинамикийн нэгдүгээр хуулийг илэрхийлэн тогтмол урсгалтай системд энерги тогтмол хэмжээтэй урсан явахыг харуулсан тэгшитгэл нь:
Σ {(m’)орох (hорох + (v2орох /2)+ g zорох)} – Σ {(m’)гарах (hгарах + (v2гарах /2)+ g zгарах)} + Q’ – W’ = 0
бөгөөд `тогтмол урсгалтай энергийн тэгшитгэл` гэж нэрлэгднэ.
m’ = массын урсгалын хэмжээ (kg/s)
h = энтальпи (kJ/kg)
v = хурд (m/s)
g = дэлхийн татах хүчний хурдатгал (m/s2)
z = өндөрлөг (m)
Q’ = дулаан дамжуулалтын хэмжээ (kW, kilowatt)
W’ = ажлын хэмжээ түвшин буюу чадал (kW, kilowatt); энэ нь арал тэнхлэгийн чадлыг илэрхийлнэ.
Энэ тэгшитгэл дээр урсгалын кинетик ба потенциал энергиүд нь {(v2 /2)+ g z } гэж илэрхийлэгдэж байгааг анзаарна уу. Дулааны энергитэй харьцуулвал эдгээр нь харьцангуй бага хэмжээтэй байдаг.
W’ нь арал тэнхлэгийн ажил хийх хэмжээ буюу арал тэнхлэгийн чадал болно. Арал тэнхлэгийн ажил нь системийн гаднах орчин дээр хийж байгаа ажлыг илэрхийлэх бөгөөд турбин, дотоод шаталт хөдөлгүүр зэргээс бүтээгдэх арал тэнхлэгээр эргэлдэх хөдөлгөөний ажлыг тодорхойлж байна.
h нь энтальпиг илэрхийлж байгаа бөгөөд дотоод энерги ба эргүүлж болох ажлыг нийтэд нь илэрхийлнэ.
VI. Тогтмол урсгалын системүүдийн тусгайлан харуулсан жишээнүүд
Турбин, насос, ба компрессор
Турбин нь шингэний урсах энергийг механик энерги болгон хувиргагч юм. Насос буюу шахуурга ба компрессор нь үүний эсрэгээр буюу механик энергийг шингэний урсах энерги болгон хувиргагч болно.
Эдгээр төхөөрөмж хэрэгслүүд нь адиабат буюу тогтмол энергитэй процесс гэж ерөнхийдөө тооцогдно. Учир нь системийг урсгал дамжин явах хугацаандаа дулааны энергийн нэмэгдэл эсвэл алдагдал бараг авахгүй. Эдгээр систем дээрхи потенциал ба кинетик энергиүд нь минимал гэж тооцогдно. Тиймээс `тогтмол урсгалтай энергийн тэгшитгэл` нь эдгээр төхөөрөмжүүд дээр
Тэнхлэгийн чадал = W’ = m’ (hорох – hгарах)
гэж бичигднэ.
Турбин, насос, компрессор зэрэг нь огт алдагдалгүй ажиллах нь боломжгүй учраас үр ашгийн алдагдал гарна. Тиймээс системийн нийт энергийн буюу энтальпийн өөрчлөлт нь системийн оролтын цэгээс гаралтын цэгийн хооронд өөрчлөлттэй байна. Турбины үр ашгийн коэффициент нь
ηтурбин = (hорох – hгарах) / (hорох – hидеал )
бөгөөд hидеал нь `идеал изэнтропийн энтальпи` буюу системээс гарах цэг дээрхи алдагдалгүй идеал нөхцөлд байх энтальпиг илэрхийлнэ.
Шахуурга буюу насосын үр ашгийн коэффициент нь
ηшахуурга = (hидеал – hорох) / (hгарах – hорох)
болно.
Буцалгагч/boiler, конденсатор, ууршуулагч
Түлшийн цахилгаан станцын буцалгагч (boiler) нь шаталтын дулааны энергийг түгээгүүрийн усруу дамжуулах үүрэгтэй тоног төхөөрөмж юм.
Конденсатор нь нэгэн төрлийн дулаан солилцуур төхөөрөмж бөгөөд шингэнээс ууршилтын дулааныг салган авах үүрэгтэй.
Ууршуулагч (evaporator) нь бага даралттай шингэнг ууршуулах үүрэгтэй тоног төхөөрөмж юм.
Эдгээр төхөөрөмж системүүдээс энерги орж гарах учраас бүгд адиабат-бус системүүд болно. `Тогтмол урсгалтай энергийн тэгшитгэл` нь эдгээр төхөөрөмжүүд дээр
hорох + q = hгарах
бөгөөд q нь дулааны энерги болно.
Түгээгүүрийн ус халаагч (feedwater heater)
Конденсатороос буцаж буцалгагчруу орох усыг халаагчыг түгээгүүрийн ус халаагч гэж нэрлэнэ. `Тогтмол урсгалтай энергийн тэгшитгэл` нь энэ төхөөрөмж дээр
Σ {(m’)орох (hорох )} = Σ {(m’)гарах (hгарах )}
байна.
Дулаан солилцуур
Дулаан солилцуур нь ханаар тусгаарлагдсан нэг шингэнээс нөгөөрүү дулааны энергийг дамжуулах төхөөрөмж юм. Дулаан дамжуулагчийг бүтнээр нь систем гэж авч үзвэл адиабат систем гэж тодорхойлж болно. Учир нь дулаан дамжуулагчаас гадагшаа энерги гарахгүй, бас гаднаас орж ирэхгүй зөвхөн систем дотроо энергийн солилцоо явж байна гэж үзэж болно. Дулаан дамжуулагч доторхи кинетик ба потенциал энерги нь минимал байх бөгөөд `Тогтмол урсгалтай энергийн тэгшитгэл` нь энэ төхөөрөмж дээр
Шингэн #1 дээрхи энергийн нэмэгдэл = Шингэн #2 дээрхи энергийн багасалт
m’1 (h1, орох – h1, гарах ) = – m’2 (h2, орох – h2, гарах )
Шахуургын хоолой ба сарниулагч (nozzle and diffuser)
Шахуургын хоолой (nozzle) нь шингэнийг хурдатгах үүрэгтэй нарийссан хоолойг тодорхойлно.
Сарниулагч нь үүний эсрэг үүрэгтэй бөгөөд шингэний хурдыг багасган сарниулах өргөссөн хоолойг тодорхойлдог.
Шахуурга ба сарниулагч хоолойнууд дээр `тогтмол урсгалтай энергийн тэгшитгэл` нь
hорох + (v2орох /2) = hгарах + (v2гарах /2)
бөгөөд потенциал энерги нь минимал гэж ихэнх тохиолдолд үзнэ.
Шахуурга ба сарниулагч хоолойнуудын үр ашгийн коэффициент нь
η = Δhбодит/Δhидеал
= (v2гарах – v2орох) / (2 (hорох – hидеал)
бөгөөд hидеал нь `идеал изэнтропийн энтальпи` буюу системээс гарах цэг дээрхи алдагдалгүй идеал нөхцөлд байх энтальпиг илэрхийлнэ.
1. Термодинамик – Үндсэн Ойлголтууд, Бодисын шинж чанарууд
Термодинамик нь аливаа бодисын энергид хамаарах шинж чанаруудын судлахуйг хэлнэ. Үүнд биет дээрхи дулааны дамжуулалт, энергийн хувирал зэргийн судлал хамаардаг. Термодинамик нь Грек гаралтай үг бөгөөд {Термэ = дулаан}, ба {Динамис = чадал} гэсэн утгуудаас бүтсэн үг болно.
Бодисын шинж чанарууд ба тэдгээрийг тодорхойлох нь тухайн бодисын байдал төлөв болон нөхцөлөөс хамаарна.
Байдал төлөв нь бодисын хатуу, шингэн, болон хий гэх мэт төлөвийг илэрхийлнэ (phase of substance).
Нөхцөл (state) нь бодисын термодинамик шинж чанаруудаар тодорхойлогдох зүйл болно.
I. Бодисын байдал төлөвүүд буюу фазууд
Бодисын байдал төлөвийг бас фаз (phase) буюу үе шат гэж тодорхойлдог. Бодисын байдал төлөв фазуудыг жагсаан тодорхойлвол:
Хатуу биет (solid) -хатуу биет бодис нь агуулах савныхаа хэлбэрийг авдаггүй.
Ханасан шингэн (saturated liquid) – авч болох дээд хэмжээний дулааны энергийг шингээж өөртөө авсан ч ууршаагүй байгаа шингэнийг ханасан шингэн гэнэ. Атмосферийн даралтын нөхцөлд 100 целсийн температурт байгаа ус нь ханасан шингэний нэг жишээ болно.
Шахагдмал шингэн (compressed liquid / sub-cooled liquid) – Ханасан байдалд очоогүй шингэнийг шахагдмал шингэн гэж тодорхойлно. Өрөөний температурт байгаа ус нь шахагдмал шингэний нэг жишээ болно. Шахагдмал шингэн нь өөртөө дулааны энерги ууршилгүйгээр нэмж шингээх боломжтой байна.
Шингэн ба уурын хольц (liquid vapor mixture) -Адилхан даралт ба температурт шингэн ба уур зэрэгцэн орших тохиолдол байна. Энэ байдлыг бас 2 фазын шингэн-уурын байдал гэдэг.
Ханасан уур (saturated vapor) – Шингэнрүү хувирах (конденсацид орох) гэж буй уурыг ханасан уур гэнэ. Жишээ нь 100 целсийн температурт байгаа усны уур.
Хэт халаасан уур (superheated vapor) -Ууршилтад шаардагдахаас илүүтэй их дулааны энерги хүлээн авсан уурыг хэт халаасан уур гэнэ. Хэт халаасан уурнаас бага зэрэг энерги алдагдсан ч конденсацид орж шингэнрүү хувирахааргүй болсон байна.
Идеал хий (ideal gas) – Хий гэдэг нь маш өндөр хэмжээний дулааны энерги авсан хэт халаалттай уур болно. Идеал хийний хуулийн тэгшитгэлээр тодорхойлогдох хийг идеал хий гэнэ. Идеал хийний тэгшитгэл нь pV = n R T, буюу (даралт) х (эзлэхүүн) = (бодисын тоо хэмжээ буюу моль) х ( идеал хийний тогтмол) х (температур) юм.
Төгс хий (perfect gas) -тодорхой дулаан (specific heat) нь тогтмол идеал хийг төгс хий гэнэ.
Жинхэнэ хий (real gas) – Идеал хийний хуулиар тодорхойлогдохгүй хийг жинхэнэ хий гэнэ.
Хийнүүдийн хольц (gas mixture) -Олон хийнүүдийн нэгдэл оршихуй.
Уур ба хийн хольц (vapor gas mixture) – Уур ба хийний хольц нь тогтмол үзэгдэл бөгөөд усны уур ба бусад хийний хольц үүний нэг жишээ болно.
II. Фазын диаграм
Бодисын фаз буюу төлөв, үе шатыг диаграммаар тодорхойлж болдог. Даралт, тодорхой эзлэхүүн, температур гэсэн гурван хэмжээс дээр фазыг нийтэд нь зургаар илэрхийлсэн нь :

wikipedia
Энэхүү 3 хэмжээст зургаас бодисын төлөв байдлыг олж мэдэж болно. Хэрэв даралт, эзлэхүүн, температур гурвын аль нэг нь тогтмол нөхцөлд энэ 3 хэмжээст диаграмыг 2 хэмжээст диаграм болгон илэрхийлж болно. Температур тогтмол нөхцөлд үүсэх төлөвийг 2 хэмжээст графаар илэрхийлсэн нь:

http://www.chm.bris.ac.uk/~chdms/Teaching/Chemical_Interactions/page_10.htm
III. Шингэн-уурын бүс
Фазын диаграмын хамгийн чухал хэсэг бүс нь шингэн ба уурын (liquid and vapor) бүс болно. Шингэн-уурын бүсийг олон янзаар зуран илэрхийлж болдог. Босоо тэнхлэг дээр нь температур эсвэл даралт, хэвтээ тэнхлэг дээр эзлэхүүн, дотоод энерги, энтальпи, энтропи зэргээр ихэвчлэн илэрхийлдэг.
Доорхи температур ба эзлэхүүний (Т-v) диаграм зурагт дүрслэн харуулснаар хонхны хэлбэртэй муруйн доорхи ногоон өнгөөр дүрслэгдсэн бүс нь шингэн-уурын хольцын бүс болно. Ханасан шингэний шугам (хөх ягаан) буюу saturated liquid line нь шингэн-уурын бүсийг шахагдмал шингэний бүсээс (compressed liquid region) заагласан цэнхэр өнгөөр зурагдсан шугам болно. Заагийн цэг буюу эцсийн хувирлын цэг (critical point) нь хонх хэлбэртэй муруйн орой цэг дээр байрлах бөгөөд энэ цэгээс дээшээгээ хийн төлөв фаз дүрслэгдэж байна. Улаан өнгөтэй шугам нь `ханасан уурын шугам`(saturated vapor line) гэж нэрлэгдэх бөгөөд хэт халаасан уур ба (saturated vapor) шингэн-уурын бүсүүдийн заагийг дүрсэлж байна. Цэнхэр өнгөтэй шулуун шугамууд нь изобар (isobar) буюу тогтмол даралтыг харуулж байна. Даралт нь шингэн-уурын бүсд өөрчлөгдөхгүй нэг хэвийн байгаа нь энэхүү бүсд даралт ба температур аль аль нь тогтмол байгааг харуулна.

http://www.wiley.com/college/moran/CL_0471129313_S/user/tutorials/tutorial2/PvT_Diag2/tv_dome.jpg
Доорхи зураг нь даралт ба эзлэхүүний диаграм (P-v) бөгөөд өмнөх диаграмтай төстэй зарчим ойлголтоор тайлбарлагдна. Изотерм (isotherm) буюу тогтмол температурыг илтгэсэн ягаан өнгөтэй шугам нь шингэн-уурын бүсд (ногоон) өөрчлөгдөхгүй тогтмол байгааг бас харж болно.

http://www.wiley.com/college/moran/CL_0471129313_S/user/tutorials/tutorial2/PvT_Diag2/pv_dome.jpg
Фазын диаграммууд нь үндсэндээ төлөв ба фазыг тайлбарлан дүрслэж харуулахад чухал хэрэгсэл мөн ч гэсэн бодисын фаз төлөвийг бодон олоход төдийлөн хэрэглэгдэхгүй болно. Бодисын төлөв, фазыг олж мэдэхийн тулд доорхи зарчмуудыг хэрэглэнэ:
- Бодисын температур нь тухайн даралт дээрхи ханалтын темперaтураас (saturation temperature) нь бага нөхцөлд тэрхүү бодис нь шахагдмал шингэн (compressed liquid) төлөвт байна.
- Бодисын температур нь тухайн даралт дээрхи ханалтын температуртай тэнцүү байвал тэрхүү бодис нь шингэн-уур (liquid vapor) төлөвт байна.
- Бодисын температур нь тухайн даралт дээрхи ханалтын температураас их байвал тэрхүү бодис нь хэт халаасан уур (superheated vapor) төлөвт байна.
- Бодисын даралт нь тухайн температур дээрхи ханалтын даралтаас их байвал тэрхүү бодис нь шахагдмал шингэн төлөвт байна.
- Бодисын даралт нь тухайн температур дээрхи ханалтын даралттай тэнцүү байвал тэрхүү бодис нь шингэн-уур төлөвт байна.
- Бодисын даралт нь тухайн температур дээрхи ханалтын даралтаас бага байвал тэрхүү бодис нь хэт халаасан уур төлөвт байна.
Шингэн-уурын хольцын усны уурын коэффициент нь
%vapor = m(v) / (m(v) + m(l))
= уурын масс / (уурын масс + шингэний масс)
гэж тодорхойлогдно.
IV. Бодисын Нөхцөл ба Термодинамик Шинж Чанарууд
Бодисын термодинамик нөхцөл (state) нь шинж чанаруудаар (properties) тодорхойлогддог. Шинж чанар нь бодисын тоо хэмжээнээс хамаарах ба үл хамаарах гэж хоёр хуваагдаж болно. Бодисын тоо хэмжээнээс хамаарах шинж чанарууд нь эзлэхүүн, цэнэг, масс, суналт зэрэг болно. Тоо хэмжээнээс үл хамаарах шинж чанарууд нь температур, даралт (pressure), хүчдэл (stress) зэрэг болно. Термодинамик бодлогуудад абсолют буюу харьцангуй бус нэгжүүдийг хэрэглэх шаардлагатай.
Масс
Термодинамик бодлогод килограмаар (kg) массыг илэрхийлнэ.
Температур
Температур нь бодисын термодинамик шинж чанар бөгөөд агуулах энергийн хэмжээнээс шалтгаалж тодорхойлогдно. Дулааны энерги бодисруу орсноороо тэр бодисын температурыг ихэсгэнэ. Дулаан биетээс хүйтэн биетрүү (их температураас бага температурлуу) дулааны энерги шилжин явна. Хоёр биер нь дулааны тэнцвэрт байдалд (equilibrium) байвал тухайн биетүүдийн хооронд дулааны энергийн шилжилт байхгүй байх бөгөөд тэдгээр биетүүд ижил температуртай байна. Хэрэв хоёр систем нь гуравдагч системтэй тэнцвэртэй байдалд байвал тэдгээр системүүд бүгд ижил температуртай байна. Энэ хуулийг термодинамикийн тэгдүгээр хууль гэнэ (0-дүгээр). Термодинамик бодлогод абсолют температурыг хэрэглэх ёстой бөгөөд тэр нэгж нь Кельвин (K) болно. Целси зэрэг нэгжийг заавал Келвинрүү хувиргах ёстой.
Даралт
Абсолют даралтыг илэрхийлэхийн тулд термодинамик бодлогод паскаль (Pa) нэгжийг хэрэглэх ёстой.
Тодорхой эзлэхүүн
Биетийн эзлэхүүнийг тухайн биетийн нэгж масст хуваасан хэмжүүр бол тодорхой эзлэхүүн юм. {m3/kg} нэгжээр тодорхой эзлэхүүн хэмжигднэ.
Дотоод энерги
Дотоод энерги (U) нь бодисын атом ба молекулуудын хөдлөл, эргэлт, ба чичрэлтийн энергүүдээс бүрднэ. Биет дээрхи даралт, биетийн потенциал ба кинетик энергүүд нь дотоод энерги биш гэдгийг анхаарна уу. Тодорхой дотоод энерги (u) нь нэгж масст байх дотоод энерги болно. Дотоод энерги нь жоуль буюу кило-жоуль ( kJ) нэгжээр илэрхийлэгдэх бөгөөд тодорхой дотоод энерги болон бодисын молекүлын жингийн (MW) үржвэртэй тэнцдэг.
U = (u)(MW)
Энтальпи
Термодинамик системийн нийт энергийг энтальпи (H) гэх бөгөөд энтальпи нь дотоод энерги (U) ба эзлэхүүнийг өөрчлөх ажил (pV) гэсэн хоёр бүрэлдэхүүнээс бүтнэ.
H = U + pV
Энтропи
Энтропи (s) нь термодинамик шинж чанар бөгөөд системд үр бүтээлтэй ажил болон хувирах боломжгүй ажлыг тодорхойлно. Энтропи нь системийн эмх замбараагүй байдлыг илэрхийлнэ. Энтропийн нэгж нь kJ / (kg K). Хатуу биетийн температур нь абсолют тэгрүү ойртоход биетийн абсолют энтропи нь бас тэгрүү ойртно.
lim (T -> 0) s = 0
Системийн нийт энтропи нь системд бий болсон бүх энтропи гаргалтуудын нийлбэр болно.
s = ΣΔs
Гиббс (Gibbs) функц
Гиббс функц нь нуугдмал дулааны өөрчлөлт, химийн урвал зэргийг тодорхойлогдоход хэрэглэгдэх бөгөөд
g = h – Ts = u + pv – Ts
гэж тодорхойлогдно.
Хелмхолць (Helmholtz) функц
Хелмхольц буюу Гельмгольц функц нь мөн нуугдмал дулаан, химийн урвал зэрэгт хэрэглэгдэх бөгөөд
a = u – Ts = h – pv – Ts
гэж тодорхойлогдно.
Дулааны багтаамж
Дулааны багтаамж буюу тодорхой дулаан нь (с) дулааны энерги (Q) нь аливаа бодисын m хэмжээтэй массын температурыг ΔT хэмжээгээр сольж чадах харьцааг тодорхойлно.
c = Q / (mΔT)
Бодис болгон өөр өөр дулааны багтаамжтай байх бөгөөд дулааны багтаамжын нэгж нь J/(kmol K) болно.
Хийнүүдийн хувьд дулааны багтаамж нь термодинамикийн ямар ажиллагаа процесс явагдаж байгаагаас хамааран өөр байдаг. Tогтмол температуртай процессийн дулааны багтаамж нь cv гэж тэмдэглэгдэх бол тогтмол даралттай процессийн дулааны багтаамж ньcp гэж тэмдэглэгднэ.
Тогтмол эзлэхүүнтэй процессд
Q = mcv ΔT
байх бөгөөд тогтмол даралттай процессд
Q = mcp ΔT
байна. Дулааны багтаамжын коэффициентийн жагсаалтуудыг доорхи таблицаас харж болно. Specific Heat Capacities гэж хайвал өөр материал, элементүүдийн дулааны багтаамжын жагсаалтыг интернетээс олж болно.

http://www.seai.ie/uploadedfiles/Education/unit5_5a_secondgraf.gif
V. Идеал Хийнүүд
Аливаа хийний даралт нь маш бага хэмжээтэй бөгөөд температур нь хувирлын цэг дээрхи температураас нь маш хол илүү гарсан хэмжээтэй нөхцөлд тухайн хий идеал нөхцөлд байгаа гэж ерөнхийдөө үздэг. (хувирлын цэг нь шингэн-уурын бүсээс хийрүү хувирах цэгийн температур – өмнөх сэдэв болон зургуудыг харна уу)
Ийм нөхцөлд очсон хийний молеулуудын хэмжээ нь тухайн молекулуудын хоорондох зайтай харьцуулвал өчүүхэн бага байх бөгөөд тэр молекулууд хоорондоо харилцахгүй болсон байна гэсэн үг.
Идеал хий нь идеал хийний хуулиар тодорхойлогдох хийг хэлдэг. Идеал хийний хуулийг тодорхойлохын тулд эхлээд Авогадрогийн Хуулийг энд тодорхойлоё.
Авогадрогийн Хууль:
Тэнцүү эзлэхүүнүүдтэй боловч өөр төрлийн хийнүүд ижилхэн температур ба даралттай байвал тэдний тус бүрийн молекулуудын тоо хэмжээ нь ижилхэн байх бөгөөд
1 грам-мольд 6.022 х 1023 ширхэг молекулууд байна.
Авогадрын тоо нь NA = 6.022 х 1023 юм.
Идеал хийний тэгшитгэл:
Даралт (P) ба температурыг (Т) абсолют нэгжээр (паскаль ба кельвин) заавал илэрхийлсэн байх шаардлагатай. (Абсолют нэгжийг хэрэглээгүй тохиолдолд даралт ба температур нь харьцангуй нэгжээр (цельс, бар, атмосфер, гэх мэт) илэрхийлэгдэх учраас жинхэнэ хариу олдох боломжгүй.)
Идеал хийний тэгшитгэл нь
p V = n R T
буюу (даралт) х (эзлэхүүн) = (универсал хийний тогтмол) х (хийний моль ) х (температур)
болно. Универсал хийний тогтмол = R = 8314 J/kmol K. Универсаль хийний тогтмол нь идеал хий бүр дээр адилхан байна.
Идеал хий нь өөрчлөлтөнд орох процессд орсон ч универсаль хийний тогтмол (R) өөрчлөгдөхгүй учраас идеал хийний (p V / T) бас тогтмол байна. Тийм учраас процессийн өмнөх (1 гэж тэмдэглэгдсэн) ба дараах (2 гэж тэмдэглэгдсэн) нөхцлүүдийг тэнцэтгэн бичиж болно:
(p1 V1)/T1 = (p2 V2)/T2
Хийний моль нь
n = m / MW = (бодисын масс) /(молекулын жин)
байх бөгөөд
молекулын тоо хэмжээ = n x NA
юм. Дээрхи тэгшитгэлүүдийг нэгтгэвэл:
p V = m (R /MW) T
болно.
Идеал хийний дулааны багтаамжын тогтмолууд өгөгдсөн байвал тэндээс доорхи тэгшитгэлийг гаргаж болно:
cp – cv = R/MW
(Tогтмол температуртай процессийн дулааны багтаамж нь cv гэж тэмдэглэгдэх бол тогтмол даралттай процессийн дулааны багтаамж ньcp гэж тэмдэглэгднэ.)
Доорхи тэгшитгэлүүдээр энтальпийн өөрчлөлт, дотоод энергийн өөрчлөлт, энтропийн өөрчлөлт зэргийг тодорхойлно:
Энтальпийн өөрчлөлт = Δh = cp ΔT
Дотоод энергийн өөрчлөлт = Δu = cv ΔT
Энтропийн өөрчлөлт = Δs = cp ln(T2/T1) – (R/MW) ln(p2/p1)
өөр хувилбар нь = Δs = cv ln(T2/T1) – (R/MW) ln(v2/v1)
Изэнтропи процесс гэдэг нь энтропи тогтмол байх процессийг хэлнэ. Изэнтропи процессд доорхи харьцаа тэгшитгэлүүд үйлчилнэ:
p2/p1= (v1/v2)k
T2/T1= (v1/v2)k-1
T2/T1= (p2/p1)(k-1)/k
k = cp / cv
удахгүй тавигдна
термодинамик ба цахилгааны инжинерчлэл сэдвүүд удахгүй тавигдна.